SOS necesito papel milimetrado
El siguiente enlace tiene un montón de superficies para imprimir: papel milimetrado, pentagrama musical, cuadrículas, ... www.papersnake.com/
FÍSICA Y QUÍMICA 4º ESO
martes, 23 de junio de 2020
martes, 2 de junio de 2020
UNIDAD DE MASA ATÓMICA (u)
La masa atómica es la masa de un átomo de un elemento. Como la unidad en el S.I., el kilogramo, es demasiado grande, es necesario elegir una unidad adecuada para medir masas tan pequeñas, por eso, se convino en usar la unidad de masa atómica, u.
" La unidad de masa atómica corresponde a la doceava parte de la masa del átomo de carbono-12"
lunes, 25 de mayo de 2020
FORMULACIÓN INORGÁNICA
FORMULACIÓN INORGÁNICA
Valencias de los elementos de la tabla periódica que tienes que estudiar
Valencias de los elementos de la tabla periódica
Teoría compuestos binarios (En elaboración)
ACTIVIDADES DE FORMULACIÓN
Óxidos metálicos
Óxidos no metálicos
Hidruros metálicos
Hidrógeno con no metales
Sales binarias
Actividades para preparar el examen de formulación
Valencias de los elementos de la tabla periódica que tienes que estudiar
Valencias de los elementos de la tabla periódica
Teoría compuestos binarios (En elaboración)
ACTIVIDADES DE FORMULACIÓN
Óxidos metálicos
Óxidos no metálicos
Hidruros metálicos
Hidrógeno con no metales
Sales binarias
Actividades para preparar el examen de formulación
miércoles, 13 de mayo de 2020
ENLACE QUÍMICO
ACTIVIDAD 1
Antes de empezar a estudiar el enlace vamos a hacer la siguiente actividad. Para ello necesitas una tabla periódica.
Dados los siguientes átomos Li, Mg, O, F, Ar, K
Entra en la siguiente página para estudiar cómo se enlazan los átomos
ENLACE QUÍMICO
ACTIVIDAD 2
ACTIVIDADES DEL ENLACE QUÍMICO
ACTIVIDAD 3: Completa la tabla, hazlo primero en papel en sucio y en lapicero.
Antes de empezar a estudiar el enlace vamos a hacer la siguiente actividad. Para ello necesitas una tabla periódica.
Dados los siguientes átomos Li, Mg, O, F, Ar, K
- Indica qué partículas constituyen esos átomos
- Razona si se trata de metales o no metales
- Los átomos se enlazan ganando o perdiendo e- de la última capa (órbita) de forma que en la capa más externa haya 8 electrones, situación más estable, se llama, regla del octeto.
- Que los electrones se colocan en orbitales, el diagrama de Moeller nos indica el orden de llenado, de forma que se empiezan rellenando los orbitales de mínima energía.
ENLACE QUÍMICO
 |
| MOLÉCULAS |
 |
| CRISTALES |
ACTIVIDAD 2
ACTIVIDADES DEL ENLACE QUÍMICO
ACTIVIDAD 3: Completa la tabla, hazlo primero en papel en sucio y en lapicero.
jueves, 7 de mayo de 2020
TABLA PERIÓDICA
INTRODUCCIÓN AL SISTEMA PERIÓDICO
Una vez conocida la existencia de los elementos químicos (los distintos tipos de átomos), la preocupación de los científicos se centró en agruparlos basándose en la existencia de propiedades similares. Tras varios intentos, la ordenación definitiva fue realizada por el químico ruso Mendeléiev, quién estableció la clasificación de los elementos químicos según sus masas atómicas. Sin embargo esta clasificación presentaba algunos fallos que se subsanaron ordenando los elementos químicos por su número atómico (Z).
Esta clasificación se denominó Sistema periódico o Tabla periódica de los elementos químicos.
Observa que los elementos de la tabla periódica están ordenados según su número atómico (Z):
- Primer elemento, el hidrógeno, H (Z=1)
- Segundo elemento, el helio, He (Z=2)
- Tercer elemento, el litio, Li (Z=3)
- Doceavo elemento, el magnesio, Mg (Z=12)
La tabla periódica consta de:
- 7 Filas o periodos, que se numeran desde n=1 a n=7
- Periodo 1 (n=1): H, He
- Periodo 2 (n=2): Li, Be, B, C, N, O, F, Ne
- Periodo 3 (n=3): Na, Mg, Al, Si, P, S, Cl, Ar
- 18 columnas, grupos o familias, con sus nombres específicos y se numeran desde 1,2,...18
- Grupo 1, Metales alcalinos: Li, Na, K, Rb, Cs, Fr
- Grupo 2, Metales alcalinotérreos: Be, Mg, Ca, Sr, Ba, Ra
- Grupo 18, Gases nobles: He, Ne, Ar, Kr, Xe, Rd
- Grupo 17, Halógenos: F, Cl, Br, I, At
- Grupo 16, Anfígenos: O, S, Se, Te, Po
Los elementos de los grupos 3,4,5,6,7,8,9,10,11 y 12 se llaman metales de transición.
8 Mayo puedes consultar ptable.com
ACTIVIDADES 7
Actividades pg 154 del libro
Observa atentamente la siguiente tabla periódica
Hay una escalerita divisoria entre metales y no metales y tenemos:
- Los elementos que están a la izquierda de la T.P, los de color azul, son los metales y tienden a ceder electrones cuando se une con otros elementos.
- Los elementos que están a la derecha de la escalerita, los amarillos, son los no metales, tienen tendencia a ganar electrones cuando se unen a otros elementos.
- Los elementos que están en la escalerita son los semimetales o metaloides. Ganan o pierden electrones dependiendo con que elemento se unan.
- Los elementos en rojo son los gases nobles y no se combinan con otros elementos.
ACTIVIDADES 8
I. Pega en tu cuaderno el esqueleto de la tabla periódica y coloréala como la anterior (Tabla periódica para recortar)
II. Pon tres ejemplos de cada uno de esos grupos, nombre y símbolo en cada caso
III. Con ayuda de otro esquema de la tabla periódica contesta a las preguntas:
a) Señala con una línea azul todos los elementos de un mismo periodo
b) Señala con una línea roja todos los elementos de una misma familia
c) Señala con un cuadradito el halógeno del tercer periodo
d) Señala con un círculo un metal alcalino
e) Señala con un aspa(X) el elemento que ocupa el lugar 20 de la tabla periódica, ¿a qué grupo pertenece?
f) Con una cruz(+) el elemento que tiene 10 protones en el núcleo
h) ¿Qué tienen en común todos los elementos e un mismo grupo?
viernes, 1 de mayo de 2020
DISTRIBUCIÓN DE LOS ELECTRONES
Vamos a estudiar la configuración electrónica o también llamada distribución electrónica. Para ello vamos a recordar el modelo atómico de Bohr.
MODELO ATÓMICO DE BHOR
(NIVELES ENERGÉTICOS)
El modelo de Rutherford no era estable, ya que según la física clásica, una carga eléctrica acelerada emite energía, y el electrón cuando gira alrededor del núcleo radiaría energía, perdería velocidad y caería sobre el núcleo. El modelo de Rutherford fallaba porque el átomo es estable.
Recuerda que según el modelo de Bohr los átomos tienen un núcleo donde se encuentran los protones y los neutrones, pero alrededor del núcleo están los electrones girando en las llamadas órbitas. Un átomo puede tener varias órbitas alrededor de su núcleo y sobre las cuales están girando sus electrones.
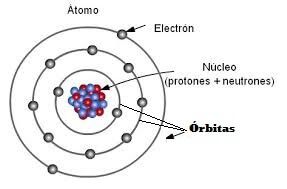

En 1913, Niels Bhor,
basándose en la teoría cuántica de Planck y Einstein y para interpretar el
espectro del átomo de hidrógeno propuso un nuevo modelo atómico:
- El electrón gira en torno al núcleo en ciertas órbitas llamadas estacionarias. Mientras el electrón se mueve en una órbita estacionaria no emite energía.
- La energía del electrón en cada órbita no puede tomar cualquier valor sino que sólo son posibles ciertas órbitas permitidas con valores de energía determinados. A cada nivel energético se le asigna un número entero n=1,2,3,.. 7, denominado número cuántico principal. El nivel más próximo al núcleo es el de menor energía.
- Los electrones pueden pasar de un nivel de energético a otro mediante absorción (ganancia) o emisión (cesión, pérdida) de un fotón con una energía igual a la diferencia energética existente entre ambos niveles:
CRÍTICAS AL MODELO DE BOHR
El modelo atómico de Bohr
explica muy bien el espectro de hidrógeno, pero no los espectros de los demás
elementos químicos. Tampoco explica hechos experimentales posteriores.
Era
necesario modificar y ampliar el modelo propuesto por Bohr.
MODELO MECANO-CUÁNTICO DEL ÁTOMO
El modelo de Bohr es un modelo unidimensional que utiliza un número cuántico (n=1, 2, 3, 4,...7) para describir la distribución de electrones en el átomo.
El modelo mecano-cuántico justifica la "ordenación" de los electrones dentro del átomo. Este nuevo modelo desecha el concepto de posición exacta donde puede estar el electrón y se habla de probabilidad matemática de encontrar al electrón en una región determinada. Se deja de hablar de órbita para llegar al concepto de orbital.
A principios del siglo XX se inició un nuevo camino en el conocimiento del átomo, el modelo atómico que se
admite es el propuesto por la mecánica cuántica (modelo de Schrödinger).
El modelo de Bohr es un modelo unidimensional que utiliza un número cuántico (n=1, 2, 3, 4,...7) para describir la distribución de electrones en el átomo.
El modelo mecano-cuántico justifica la "ordenación" de los electrones dentro del átomo. Este nuevo modelo desecha el concepto de posición exacta donde puede estar el electrón y se habla de probabilidad matemática de encontrar al electrón en una región determinada. Se deja de hablar de órbita para llegar al concepto de orbital.
Un orbital atómico es la región del espacio
en la cual es muy probable (superior al 90 %) encontrar al electrón con una
energía determinada.
Así los orbitales, lugares del espacio alrededor del núcleo donde hay una alta probabilidad de encontrar los electrones, se designan con un número y una letra, en cada orbital caben dos electrones.
Ejemplo: El orbital 1s
Para saber como se colocan los electrones en los orbitales, vamos a utilizar el diagrama de Moeller
EJEMPLOS
Vamos a ver en que orbitales se colocan los electrones del litio
Configuración electrónica del neón
ACTIVIDAD 6
Escribe las configuraciones electrrónicas de los tres primeros metales alcalinos (Li, Na, K, Rb, Cs, Fr) y observa la configuración de la última capa de cada uno de ellos, ¿qué tienen en común?. Deja un hueco para añadir conclusiones al final de cada grupo.
Nota: Solo tienes que seguir la flecha en el diagrama de Moeller. Puedes consultar, https://ptable.com/
Haz lo mismo con:
- Metales alcalinotérrreos
- Gases nobles
- Halógenos
- Anfígenos
Empieza así:
Metales alcalinos (Li, Na, K, Rb, Cs, Fr)
Li(Z=3):
martes, 28 de abril de 2020
lunes, 27 de abril de 2020
IONES
IONES
Los iones son átomos que pierden o ganan electrones, así tenemos:
Ejemplo
Aniones, son átomos que ganan electrones y por tanto quedan cargados negativamente.
Ejemplo
Después de copiar la teoría anterior en tu cuaderno, realiza las siguientes actividades en tu cuaderno
ACTIVIDADES 5
I. Haz un dibujo para el ejemplo del oxígeno
II. Representa un átomo neutro que tiene Z= 12 y A=23 que pierde 2 electrones (Esquema si, dibujo no)
III. Representa un átomo neutro que tiene Z= 7 y A = 15 y gana 3 electrones (Esquema si, dibujo no)
IV. Completa la siguiente tabla: tabla de isotopos
IV. Completa la siguiente tabla: tabla de isotopos
Suscribirse a:
Comentarios (Atom)















