Vamos a estudiar la configuración electrónica o también llamada distribución electrónica. Para ello vamos a recordar el modelo atómico de Bohr.
MODELO ATÓMICO DE BHOR
(NIVELES ENERGÉTICOS)
El modelo de Rutherford no era estable, ya que según la física clásica, una carga eléctrica acelerada emite energía, y el electrón cuando gira alrededor del núcleo radiaría energía, perdería velocidad y caería sobre el núcleo. El modelo de Rutherford fallaba porque el átomo es estable.
Recuerda que según el modelo de Bohr los átomos tienen un núcleo donde se encuentran los protones y los neutrones, pero alrededor del núcleo están los electrones girando en las llamadas órbitas. Un átomo puede tener varias órbitas alrededor de su núcleo y sobre las cuales están girando sus electrones.
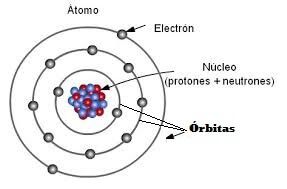

En 1913, Niels Bhor,
basándose en la teoría cuántica de Planck y Einstein y para interpretar el
espectro del átomo de hidrógeno propuso un nuevo modelo atómico:
- El electrón gira en torno al núcleo en ciertas órbitas llamadas estacionarias. Mientras el electrón se mueve en una órbita estacionaria no emite energía.
- La energía del electrón en cada órbita no puede tomar cualquier valor sino que sólo son posibles ciertas órbitas permitidas con valores de energía determinados. A cada nivel energético se le asigna un número entero n=1,2,3,.. 7, denominado número cuántico principal. El nivel más próximo al núcleo es el de menor energía.
- Los electrones pueden pasar de un nivel de energético a otro mediante absorción (ganancia) o emisión (cesión, pérdida) de un fotón con una energía igual a la diferencia energética existente entre ambos niveles:
CRÍTICAS AL MODELO DE BOHR
El modelo atómico de Bohr
explica muy bien el espectro de hidrógeno, pero no los espectros de los demás
elementos químicos. Tampoco explica hechos experimentales posteriores.
Era
necesario modificar y ampliar el modelo propuesto por Bohr.
MODELO MECANO-CUÁNTICO DEL ÁTOMO
El modelo de Bohr es un modelo unidimensional que utiliza un número cuántico (n=1, 2, 3, 4,...7) para describir la distribución de electrones en el átomo.
El modelo mecano-cuántico justifica la "ordenación" de los electrones dentro del átomo. Este nuevo modelo desecha el concepto de posición exacta donde puede estar el electrón y se habla de probabilidad matemática de encontrar al electrón en una región determinada. Se deja de hablar de órbita para llegar al concepto de orbital.
A principios del siglo XX se inició un nuevo camino en el conocimiento del átomo, el modelo atómico que se
admite es el propuesto por la mecánica cuántica (modelo de Schrödinger).
El modelo de Bohr es un modelo unidimensional que utiliza un número cuántico (n=1, 2, 3, 4,...7) para describir la distribución de electrones en el átomo.
El modelo mecano-cuántico justifica la "ordenación" de los electrones dentro del átomo. Este nuevo modelo desecha el concepto de posición exacta donde puede estar el electrón y se habla de probabilidad matemática de encontrar al electrón en una región determinada. Se deja de hablar de órbita para llegar al concepto de orbital.
Un orbital atómico es la región del espacio
en la cual es muy probable (superior al 90 %) encontrar al electrón con una
energía determinada.
Así los orbitales, lugares del espacio alrededor del núcleo donde hay una alta probabilidad de encontrar los electrones, se designan con un número y una letra, en cada orbital caben dos electrones.
Ejemplo: El orbital 1s
Para saber como se colocan los electrones en los orbitales, vamos a utilizar el diagrama de Moeller
EJEMPLOS
Vamos a ver en que orbitales se colocan los electrones del litio
Configuración electrónica del neón
ACTIVIDAD 6
Escribe las configuraciones electrrónicas de los tres primeros metales alcalinos (Li, Na, K, Rb, Cs, Fr) y observa la configuración de la última capa de cada uno de ellos, ¿qué tienen en común?. Deja un hueco para añadir conclusiones al final de cada grupo.
Nota: Solo tienes que seguir la flecha en el diagrama de Moeller. Puedes consultar, https://ptable.com/
Haz lo mismo con:
- Metales alcalinotérrreos
- Gases nobles
- Halógenos
- Anfígenos
Empieza así:
Metales alcalinos (Li, Na, K, Rb, Cs, Fr)
Li(Z=3):




No hay comentarios:
Publicar un comentario