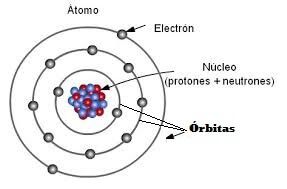
INTRODUCCIÓN AL SISTEMA PERIÓDICO
Una vez conocida la existencia de los elementos químicos (los distintos tipos de átomos), la preocupación de los científicos se centró en agruparlos basándose en la existencia de propiedades similares. Tras varios intentos, la ordenación definitiva fue realizada por el químico ruso Mendeléiev, quién estableció la clasificación de los elementos químicos según sus masas atómicas. Sin embargo esta clasificación presentaba algunos fallos que se subsanaron ordenando los elementos químicos por su número atómico (Z).
Esta clasificación se denominó Sistema periódico o Tabla periódica de los elementos químicos.
Observa que los elementos de la tabla periódica están ordenados según su número atómico (Z):
- Primer elemento, el hidrógeno, H (Z=1)
- Segundo elemento, el helio, He (Z=2)
- Tercer elemento, el litio, Li (Z=3)
- Doceavo elemento, el magnesio, Mg (Z=12)
La tabla periódica consta de:
7 Filas o periodos, que se numeran desde n=1 a n=7
-
Periodo 2 (n=2): Li, Be, B, C, N, O, F, Ne
Periodo 3 (n=3): Na, Mg, Al, Si, P, S, Cl, Ar
-
- 18 columnas, grupos o familias, con sus nombres específicos y se numeran desde 1,2,...18
Grupo 1, Metales alcalinos: Li, Na, K, Rb, Cs, Fr
Grupo 2, Metales alcalinotérreos: Be, Mg, Ca, Sr, Ba, Ra
Grupo 18, Gases nobles: He, Ne, Ar, Kr, Xe, Rd
Grupo 17, Halógenos: F, Cl, Br, I, At
Grupo 16, Anfígenos: O, S, Se, Te, Po
Los elementos de los grupos 3,4,5,6,7,8,9,10,11 y 12 se llaman metales de transición.
ACTIVIDADES 7
Actividades pg 154 del libro
Observa atentamente la siguiente tabla periódica
Hay una escalerita divisoria entre metales y no metales y tenemos:
Los elementos que están a la izquierda de la T.P, los de color azul, son los metales y tienden a ceder electrones cuando se une con otros elementos.
Los elementos que están a la derecha de la escalerita, los amarillos, son los no metales, tienen tendencia a ganar electrones cuando se unen a otros elementos.
Los elementos que están en la escalerita son los semimetales o metaloides. Ganan o pierden electrones dependiendo con que elemento se unan.
Los elementos en rojo son los gases nobles y no se combinan con otros elementos.
ACTIVIDADES 8
II. Pon tres ejemplos de cada uno de esos grupos, nombre y símbolo en cada caso
III. Con ayuda de otro esquema de la tabla periódica contesta a las preguntas:
a) Señala con una línea azul todos los elementos de un mismo periodo
b) Señala con una línea roja todos los elementos de una misma familia
c) Señala con un cuadradito el halógeno del tercer periodo
d) Señala con un círculo un metal alcalino
e) Señala con un aspa(X) el elemento que ocupa el lugar 20 de la tabla periódica, ¿a qué grupo pertenece?
f) Con una cruz(+) el elemento que tiene 10 protones en el núcleo
h) ¿Qué tienen en común todos los elementos e un mismo grupo?